Урок №20. Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой h (эта), измеряется в процентах или долях.
m практическая х100%
h = m теоретичееская
V практический х100%
h = V теоретичееский
m практическая (MgSO4) = 5,5 г
_____________________
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
120 г/моль · 0,05 моль = 6 г
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
реакции.
1. Записываем краткое условие задачи
m(CaO) = 16,8 г
h =80% или 0,8
_________________
m практ (CaC2) = ?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
1. Записываем краткое условие задачи
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
h = 85% или 0,85
____________________
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
Vтеоретич(CO2) =
28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
Следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
V = ν · Vm m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием . Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н. у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
ВЫЧИСЛЕНИЕ ВЫХОДА ПРОДУКТА РЕАКЦИИ В ПРОЦЕНТАХ ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО, ЕСЛИ ИЗВЕСТНЫ МАССЫ ИСХОДНОГО ВЕЩЕСТВА И ПРОДУКТА РЕАКЦИИ
Задача 1. Через известковую воду, содержащую 3,7 г гидроксида кальция, пропустили углекислый газ. Выпавший осадок отфильтровали, высушили, взвесили. Его масса оказалась равной 4,75 г. Вычислить выход продукта реакции (в процентах) от теоретически возможного.
Дано:I способ.
Определим количества приведенных в условии задачи веществ:
v = m /
M = 3,7 г /
74 г/моль = 0,05 моль;
v = 0,05 моль
v(CaCO 3
) = m(CaCO 3
) /
M(CaCO 3
) = 4,75 г /
100 г/моль = 0,0475 моль;
v(CaCO 3
) = 0,0475 моль
Запишем уравнение химической реакции:
Ca(OH) 2
Из уравнения химической реакции следует, что из 1 моль Ca(OH) 2
образуется 1 моль CaCO 3
, а значит, из 0,05 моль Ca(OH) 2
теоретически должно получиться столько же, то есть 0,05 моль CaCO 3
. Практически же получено 0,0475 моль CaCO 3
, что составит:
w вых.
(CaCO 3
) = 0,0475 моль *
100 % /
0,05 моль = 95 %
w вых.
(CaCO 3
) = 95 %
II способ.
Принимаем во внимание массу исходного вещества (гидроксида кальция) и уравнение химической реакции:
Ca(OH) 2
Рассчитаем по уравнению реакции, сколько теоретически образуется карбоната кальция.
Из 74 г Ca(OH) 2Отсюда х = 3,7 г * 100 г / 74 г = 5 г, m(CaCO 3 ) = 5 г
Это означает, что из данных по условию задачи 3,7 г гидроксида кальция теоретически (из расчётов) можно было бы получить 5 г карбоната кальция, а практически получено лишь 4,75 г продукта реакции. Из этих данных определим выход карбоната кальция (в %) от теоретически возможного:
5 г CaCO 3
составляют 100% - ный выход
4,75 г CaCO 3
составляют х %
x = 4,75 моль
*
100 %
/
5 г = 95 % ;
w
вых.
(CaCO
3
) = 95 %
Ответ: выход карбоната кальция составляет 95 % от теоретически возможного.
Задача 2. При взаимодействии магния массой 36 г с избытком хлора получено 128,25 г хлорида магния. Определить выход продукта реакции в процентах от теоретически возможного.
Дано: Рассмотрим два способа решения этой задачи: с использованием величины количества вещества и массы вещества .I способ.
Из данных по условию задачи значений масс магния и хлорида магния рассчитаем значения количества этих веществ:
v(Mg) = m(Mg) /
M(Mg) = 36 г /
24 г/моль = 1,5 моль; v(Mg) = 1,5 моль
v(MgCl 2
) = m(MgCl 2
)/
M(MgCl 2
) = 128,25 г /
95 г/моль = 1,35 моль;
v(MgCl 2
) = 1,35 моль
Составим уравнение химической реакции:
Mg
Воспользуемся уравнением химической реакции. Из этого уравнения следует, что из 1 моль магния можно получить 1 моль хлорида магния, а, значит, из данных 1,5 моль магния можно теоретически получить столько же, то есть 1,5 моль хлорида магния. А практически получено лишь 1,35 моль. Поэтому выход хлорида магния (в %) от теоретически возможного составит:
1,5 моль MgCl 2х = 1,35 моль * 100% / 1,5 моль = 90%, т.е. w вых. (MgCl 2 ) = 90%
II способ.
Рассмотрим уравнение химической реакции:
Mg
В первую очередь по уравнению химической реакции определим, сколько граммов хлорида магния можно получить из данных по условию задачи 36 г магния.
Из 24 г Mg 2Отсюда х = 36 г * 95 г / 24 г = 142,5 г; m(MgCl 2 ) = 142,5 г
Это означает, что из данного количества магния можно было бы получить 142,5 г хлорида магния (теоретический выход, составляющий 100%). А получено всего 128,25 г хлорида магния (практический выход).
Рассмотрим теперь, сколько процентов составляет практический выход от теоретически возможного:
х = 128,25 г * 100 % / 142,5 г = 90 %, то есть w вых. (MgCl 2 ) = 90%
Ответ: выход хлорида магния составляет 90% от теоретически возможного.
Задача 3. Металлический калий массой 3,9 г поместили в дистиллированную воду объемом 50 мл. В результате реакции получили 53,8 г раствора едкого кали с массовой долей вещества равной 10%. Вычислить выход едкого кали (в процентах) от теоретически возможного.
Дано:2K
На основе этого уравнения химической реакции сделаем расчёты.
Вначале определим массу едкого кали, которую теоретически можно было бы получить из данной по условию задачи массы калия.
Отсюда: x = 3,9 г * 112 г / 78 г = 5,6 г m(KOH) = 5,6 г
Из этой формулы выражаем m в-ва:
m в-ва = m р-ра *
w в-ва /
100%
Определим массу едкого кали, находящегося в 53,8 г 10% -ного его раствора:
m(KOH) = m р-ра *
w(KOH) /
100% = 53,8 г *
10% /
100% = 5,38 г
m(KOH) = 5,38 г
Наконец, рассчитываем выход едкого кали в процентах от теоретически возможного:
w вых. (КОН) = 5,38 г /
5,6 г *
100% = 96%
w
вых.
(КОН) = 96%
Ответ: Выход едкого кали составляет 96% от теоретически возможного.

РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ
«НА ВЫХОД ПРОДУКТА ОТ ТЕОРЕТИЧЕСКИ ВОЗМОЖНОГО»
Массовая доля выхода продукта реакции (ω - «омега»)

Многие химические реакции не доходят до конца.
При взаимодействии органических веществ часто образуются побочные продукты.
При гетерогенных реакциях часть веществ просто не вступает в реакции.
Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.

1. Даны массы
исходного вещества и продукта реакции.
1. Даны массы
исходного вещества и продукта реакции.
Определить выход продукта реакции.

Массовая доля выхода продукта реакции (ω - «омега»)

Многие химические реакции не доходят до конца.
При взаимодействии органических веществ часто образуются побочные продукты.
При гетерогенных реакциях часть веществ просто не вступает в реакции.
Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.

1. Даны массы
исходного вещества и продукта реакции.
1. Даны массы
исходного вещества и продукта реакции.
Определить выход продукта реакции.

Многие химические реакции не доходят до конца.
При взаимодействии органических веществ часто образуются побочные продукты.
При гетерогенных реакциях часть веществ просто не вступает в реакции.
Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность соединений всегда приводит к потерям газообразных веществ.
Определить выход продукта реакции.


1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и «Найти».
5) Вычисли массовую долю продукта реакции по отношению массы практической к массе теоретической, которая указана в «дано».

При действии алюминия на оксид цинка массой 32,4г получили 24 г цинка. Найдите массовую долю выхода продукта реакции.




1) Прочитай внимательно условие задачи
1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и «Найти».
3) Составь уравнение реакции (не забудь расставить коэффициенты).
4) Вычисли массу теоретическую продукта реакции, по уравнению реакции.
5) Вычисли массу практическую продукта реакции, воспользовавшись обратной формулой (умножь массу теоретическую на долю выхода)

Определите массу оксида алюминия, которая может быть получена из 23,4 г гидроксида алюминия, если выход реакции составляет 92% от теоретически возможного.




Курс школьной химии представляет собой вводное пособие в сложную науку. С самого начала ученики пытаются понять, как решать расчетные задачи. Пусть на первых этапах они имеют маленькое практическое применение, но если школьник узнал о том, например, вступивших в реакцию веществ, то он вполне может претендовать на серьезные достижения.
Рассмотрим простой пример задачи, на основе которой можно научиться решать более сложные. Предположим, что на полное сгорание (II) вам понадобилось 11,2 литра. Сколько граммов CO2 вам удалось получить?
2. Уравняем по кислороду. Есть некоторое правило, которое в большинстве случаев может вам помочь. Начинайте расставлять коэффициенты с того вещества, количество атомов которого нечетно. В данном случае это кислород в молекуле CO. К нему поставим коэффициент 2. Так как слева образовалось два атома углерода, а справа - один, то и перед CO2 поставим 2. Таким образом, получаем:
Как видите, в левой и правой частях по четыре атома кислорода. Углерод также находится в балансе. Следовательно, уравняли верно.

3. Далее необходимо найти количество O2. Определение для школьников слишком громоздко и тяжко для запоминания, поэтому воспользуемся другим методом. Вспомним, что существует молярный объем, который равен 22,4 л/моль. Вам необходимо найти, сколько молей (n) вступило в реакцию: n=V/V м. В нашем случае n=0,5 моль.
4. Теперь составим пропорцию. Количество вступившего в реакцию кислорода в два раза меньше n (CO2). Это следует из того, что 0,5 моль /1 = x моль /2. Простое отношение двух величин помогло составить верное уравнение. Когда мы нашли x = 1, можем получить ответ на вопрос, как находить массу.
5. Правда для начала придется вспомнить еще одну формулу: m=M*n. Последнюю переменную нашли, но что делать с M? - это экспериментально установлено значение относительно водорода. Именно она обозначается буквой M. Теперь мы знаем, что m(CO2)= 12 г/моль * 1 моль = 12 г. Вот и получили ответ. Как видите, нет ничего сложного.

Эта задача весьма легкая относительно множества других. Однако главное - понять, как находить массу. Представьте себе молекулу какого-нибудь вещества. Давно известно, что моль состоит из 6*10^23 молекул. В то же время в Периодической системе существует установленная масса элемента на 1 моль. Иногда надо рассчитать молярную массу вещества. Предположим M(H20)=18 граммов/моль. То есть одна имеет M=1 грамм/моль. Но вода содержит в себе два атома H. Также не забываем о наличии кислорода, что дает нам еще 16 граммов. Суммируя, получаем 18 граммов/моль.
Теоретический подсчет массы впоследствии будет иметь практическое применение. Особенно для учащихся, которых ожидает химический практикум. Не стоит бояться этого слова, если вы учитесь в непрофильной школе. Но если химия - ваш профильный предмет, лучше не запускать базовые понятия. Итак, теперь вы знаете о том, как находить массу. Помните, что в химии очень важно быть последовательным и внимательным человеком, который не только знает некоторые алгоритмы, но и умеет их применять.
Задачи на практический выход.
1 .Вычислите объем аммиака, который можно получить, нагревая 20г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
2NH 4 Cl + Ca(OH) 2 = 2NH 3 +H 2 O; Mr(NH 4 Cl) =53,5
NH 4 Cl +0,5Са(ОH ) 2 = NH 3 +0,5H 2 O
1)Рассчитаем теоретический выход
20/53,5=Х/22,4; Х=8,37л(это теоретический выход)
2) Рассчитаем практический выход
V (практического)=V (теоретического)/выход прдукта*100%
V (практического)=8,37л*98%/(делим на) 100% = 8.2л
Ответ: 8,2 л N Нз
2.Из 320г сернистого колчедана, содержащего 45% серы, было получено 405г серной кислоты (расчёт на безводную кислоту). Вычислите массовую долю выхода серной кислоты.
Составим схему производственного получения серной кислоты
320г 45% 405г, ή-?
FeS 2 → S → H 2 SO 4
1)Рассчитаем долю серы в колчедане
2)Рассчитаем теоретический выход серной кислоты

3) Рассчитаем выход продукта в процентах
З.Вычислите массу фосфора необходимую для получения 200 кг фосфорной кислоты, если массовая доля выхода продукта составляет 90%.
Составим схему производственного получения фосфорной кислоты
Х 200кг,ή=90%
P → H 3 PO 4
1)Рассчитаем массу теоретического выхода фосфорной кислоты
m
т =


2) Рассчитаем массу фосфора
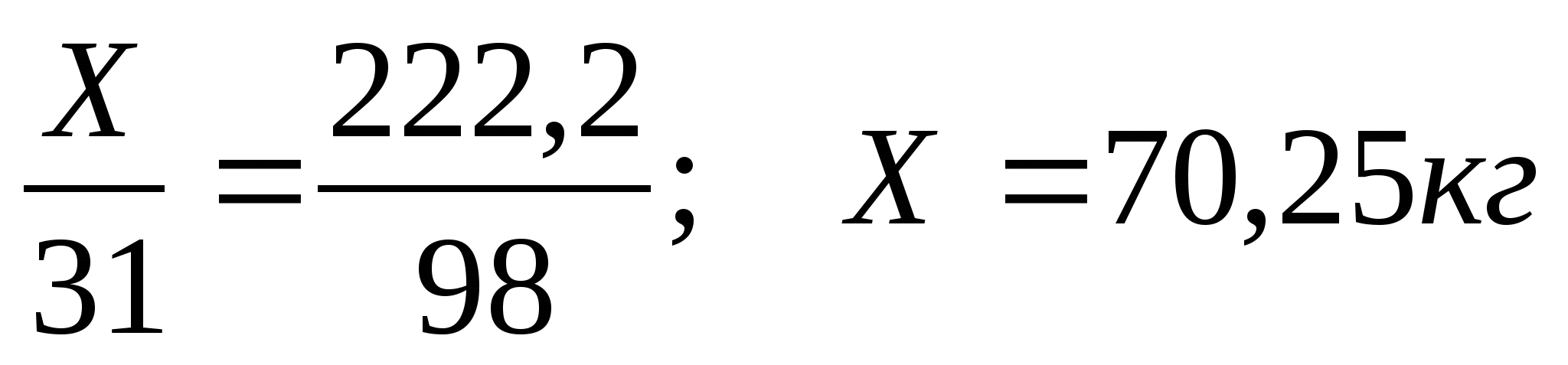
Ответ:70,Зкг
4.Юный химик на занятиях кружка решил получить азотную кислоту реакцией обмена между нитратом калия и концентрированной серной кислотой. Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
5.При нагревании нитрита аммония N Н 4 NO 2 образуются азот и вода. Вычислите объем азота (н. у), который можно получить при разложении 6,4г нитрита аммония, если объемная доля выхода азота составляет 89%.
6.Вычислите объем оксида азота (II), который можно получит при каталитическом окислении в лаборатории 5,6л аммиака, если объемная доля выхода оксида азота (II ) равна 90%.
7.Металлический барий получают восстановлением его оксида металлическим алюминием c образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг бария.
Ответ: 92,5%
8.Определите, какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 2,1 л (н. у) оксида азота (IV ), если объемная доля выхода оксида азота (IV ) равна 94%.
Ответ: 3,19
9.Какой объем оксида серы (IV ) надо взять для реакции окисления кислородом, чтобы получить оксид серы (V I) массой 20г. если выход продукт равен 80% (н.у).?
2SO
2
+ O
2
= 2SO
3
; V.(SO
2
)
=22.4
л; Mr(SO
3
) =80
1) Рассчитаем теоретический выход
m
(теорет) = 
2)Рассчитаем массу SO 2

10.При нагревании смеси оксида кальция массой 19,6г с коксом массой 20г получили карбид кальция массой 16г. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90%.
Ответ: 71.4%
11 .Через раствор массой 50г с массовой долей иодида натрия 15% пропустили избыток хлора, выделился йод массой 5,6г. Определите выход продукта реакции от теоретически возможного в %.
Ответ: 88,2%.
12.Определить выход силиката натрия в % к теоретическому, если при сплавлении 10 кг гидроксида натрия с оксидом кремния (IV ) получено 12,2 кг силиката натрия. Ответ 80%
13.Из 4 кг оксида алюминия удаётся выплавить 2 кг алюминия. Вычислите массовую долю выхода алюминия от теоретически возможного.
Ответ:94,3%
14.Вьичислите объем аммиака, который получается при нагревании смеси хлорида аммония массой 160,5 г и гидроксида кальция, если объемная доля выхода аммиака от теоретически возможного составляет 78%.
Ответ:52.4л
15.Какое количество аммиака потребуется для получения 8 т нитрата аммония, если выход продукта составляет 80% от теоретически возможного?
Ответ:2,IЗт
16.Какое количество уксусного альдегида может быть получено по реакции Кучерова, если в реакцию вступило 83,6 л ацетилена, а практический выход составил 80% от теоретически возможного?
Ответ: 131,З6г
17.Какое количество бензола потребуется для получения 738г нитробензола, если практический выход составляет 92% от теоретического.?
Ответ 508.75г
1 8.При нитрировании 46,8 бензола получено 66,42г нитробензола. Определите практический выход нитробензола в % от теоретически возможного.
19.Сколько граммов бензола можно получить из 22,4 л ацетилена, если практический выход бензола составил 40%.?
20.Какой объем бензола (ρ=0,9г/см 3) потребуется, чтобы получить 30,75г нитробензола, если выход при нитровании составляет 90% от теоретически возможного?
21 .Из 32г этилена было получено 44г спирта. Вычислите практический выход продукта в % от теоретически возможного.
22.Сколько граммов этилового спирта можно получить из 1м 3 природного газа, содержащего 6% этилена, если практический выход составил 80%?
23.Какое количество кислоты и спирта необходимо для получения 29,6г уксуснометилового эфира, если его выход составил 80% от теоретически возможного?
24.При гидролизе 500кг древесины, содержащей 50% целлюлозьг, получается 70кг глюкозы. Вычислите ее практический выход в % от теоретически возможного.
25.Сколько глюкозы получается из 250 кг опилок, содержащих 40% глюкозы. Какое количество спирта можно получить из этого количества глюкозы при 85%-ном практическом выходе?
Ответ:43,43г
26.Сколько граммов нитробензола нужно взять, чтобы восстановлением получить 186г анилина, выход которого составляет 92% от теоретического 27. Вычислите массу сложного эфира, который получили из 460г муравьиной кислоты и 460г этилового спирта. Выход эфира от теоретически возможного составляет 80%.
28.При обработке 1т фосфорита, содержащего 62% фосфата кальция, серной кислотой было получено 910,8кг суперфосфата. Определить выход суперфосфата в % по отношению к теоретическому.
Са 3 (РО 4) 2 + 2Н 2 S 0 4 = Са (Н 2 Р0 4) 2 + 2СаS 0 4
З0.Для получения кальциевой селитры, 1т мела обработали разбавленной азотной кислотой. При этом выход кальциевой селитры составил 85% по отношению к теоретическому. Сколько селитры было получено?
Ответ: 1394кг
31 .Из 56кг азота было синтезировано 48 кг аммиака. Каков выход аммиака в процентах к теоретическому.
Ответ: 70,5%
32. 34 кг аммиака пропустили через раствор серной кислоты. Выход сульфата аммония составил 90% от теоретического. Сколько килограммов сульфата аммония получено?
Ответ:118,8кг
З3.При окислении З4кг аммиака было получено 54кг окиси азота (II ).Вычислить выход окиси азота в % по отношению к теоретическому.
34.В лаборатории аммиак получают взаимодействием хлористого аммония с гашёной известью. Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Ответ:30,6г
35.Из 60кг водорода и соответствующего количества азота было синтезировано 272 кг аммиака. Каков выход аммиака в % к теоретически возможному?
36. Из 86,7г натриевой селитры, содержащей 2% примесей, получено 56,7г азотной кислоты, каков выход азотной кислоты в % к теоретически возможному?
Ответ: 90%.
37.При пропускания аммиака через 6Зкг 50% раствора азотной кислоты было получено З8кг аммиачной селитры. Каков выход ее в % к теоретически возможному?
38.Для получения фосфорной кислоты было израсходовано ЗI4кг фосфорита, содержащего 50% фосфата кальция. Выход фосфорной кислоты составил 95%.Сколько кислоты было получено?
Ответ:94,Зкг
39. 49кг 50% раствора серной кислоты было нейтрализовано гашёной известью, причем получилось 30,6кг сульфата кальция. Определить выход продукта в % к теоретическому.
40.Фосфор получают в технике по уравнению реакции;
Саз (Р0 4) 2 + 3SiО 2 +5С →ЗСaSi О 3 + 2Р +5СО
Каков выход фосфора в % к теоретическому, если его получилось 12,4 кг из 77 кг фосфорнокислого кальция?
Ответ: 80,5%
41 .Вычислите выход карбида кальция в % к теоретическому, если 15,2кг его
были получены из I4кг окиси кальция.
42. Ацетилен получают взаимодействием.карбида кальция с водой
СаС 2 +2Н 2 0= Са(ОН) 2 +С 2 Н 2
Сколько граммов ацетилена получится, если израсходовано 33,7г карбида кальция, содержащего 5% примесей и выход ацетилена составил 90% к теоретическому?
Ответ: 11,7г
43.При действии соляной кислоты на 50г мела получилось 20г углекислого газа. Каков выход его в % к теоретическому?
Ответ: 90,9%
44.При обжиге 1т известняка, содержащего 10% примесей, выход углекислого газа составил 95%. Сколько килограммов углекислого газа было получен?
Ответ: 376,2 кг.
45. Определить выход силиката натрия в % к теоретическому, если при сплавлении 10кг едкого натра с песком получено 12,2 кг силиката натрия.








